Ахалазия
Ахалазия – термин греческого происхождения, который означает отсутствие способности расслабиться.
Ахалазия является редким первичным расстройством двигательной функции пищевода. Оно характеризуется отсутствием перистальтики и нарушением релаксации нижнего пищеводного сфинктера (НПС), что приводит к нарушению прохождения пищи и застою ее в пищеводе.
Sir Thomas Willis, англичанин, описал кардиоспазм у пациента и его лечение посредством дилатации с помощью губки прикрепленной к китовому усу в 1672 году. Ernest Heller, немец, сделал первую успешную эзофагомиотомию 241 год спустя – 14 апреля 1913. В 1937 году F. C. Lendrum предположил, что причиной функциональной обструкции пищевода является недостаточность нижнего сфинктера пищевода и его невозможность расслабиться, после этого название заболевания было изменено с кардиоспазма на ахалазию. Dor в 1962 году сообщил о выполнении передней частичной фундопликации по собственной методике, а в 1963 году André Toupet сообщили о выполнении задней частичной фундопликации. Shimi и его коллеги в Соединенном Королевстве сделали первую миотомию по Heller лапароскопически в 1991 году, через 77 лет после первой операции Heller.
Эпидемиология ахалазии изучена не в полной мере. Заболеваемость ахалазией во всем мире оценивается в 0,5-1,0 случаев на 100 000 человек в год. Встречается в любом возрасте, но имеет пик заболеваемости в возрасте от 30 до 60 лет и крайне редко в течение первых 2 лет жизни. Например, в Университете Калифорнии, Сан-Франциско (UCSF), средний возраст на момент постановки диагноза составил 48 лет. Мужчины и женщины в равной степени подвержены, без этнической предрасположенности к болезни. Имели место сообщения о "семейных ахалазиях", но они составляют менее 1% всех случаев, описанных в литературе. Тройной-синдром (ААА – синдром Ахалазии-Аддисонианизма-Алакримии), или болезнь Allgrove, является редким заболеванием, состоящее из ахалазии, алакримии и адренокортикотропный гормон резистентной надпочечниковой недостаточности. Хотя ахалазия значительно повышает риск развития рака пищевода, продолжительные исследования указывают на то, что ахалазия не влияет на продолжительность жизни. Средний возраст смерти пациентов с ахалазии в одной серии исследований составил 80 лет, таким образом, это указывает на относительно низкую частоту рака пищевода.
ПАТОГЕНЕЗ И ЭТИОЛОГИЯ
Двигательная иннервация пищевода обеспечивается блуждающим нервом с помощью подслизистого нервного сплетения или Мейсснерова сплетения (рис. 1А). Иннервация пищевода отличается в проксимальных и дистальных отделах. Поперечно-полосатые мышцы проксимального отдела пищевода иннервируется соматическими эфферентными волокнами блуждающего нерва (рис. 1А). С другой стороны, гладкая мускулатура дистального отдела пищевода иннервируется преганглионарными волокнами блуждающего нерва из клеточных тел, расположенных в дорсальном двигательном ядре. Преганглионарные волокона в первую очередь иннервируют подслизистое сплетение с помощью холинергических волокон. Стенки пищевода и его нижнего сфинктера далее иннервируются постганглионарными нейронами, состоящими из стимулирующих и ингибирующих нейронов. Постганглионарные стимулирующие нейроны высвобождают ацетилхолин, в то время как ингибирующие нейроны высвобождают оксид азота (NO) и вазоактивный интестинальный пептид приводящие к сокращению и расслаблению пищевода и его нижнего сфинктера, соответственно (рис. 1В).
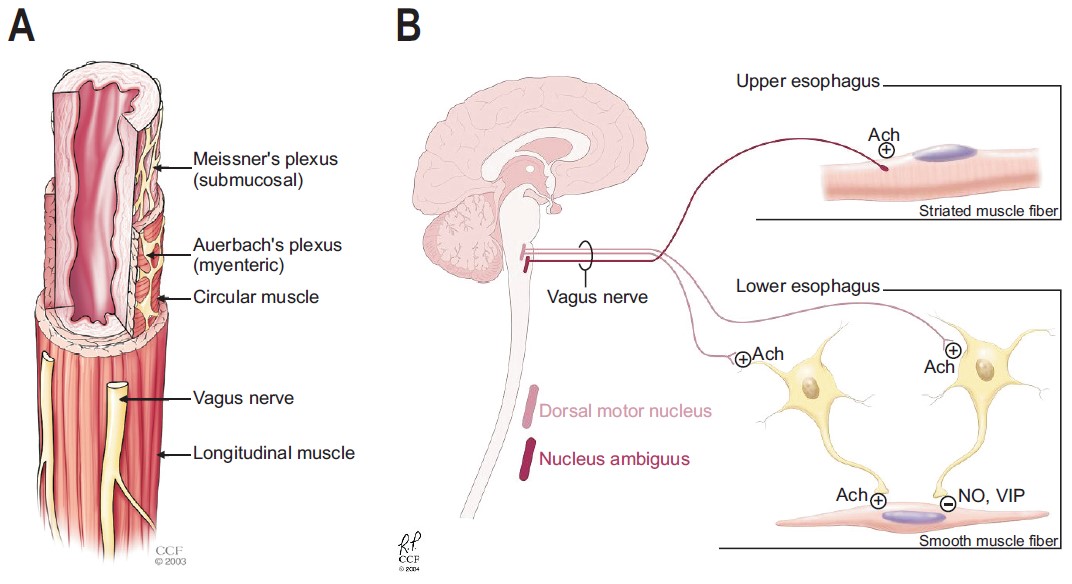
Рисунок 1.Источник: AtesF, VaeziMF. The Pathogenesis and Management of Achalasia: Current Status and Future Directions. Gut and Liver. 2015;9(4):449-463. doi:10.5009/gnl14446.
В дополнение к тоническому сокращению и расслаблению, ингибирующие нейроны также имеют важное значение для нормальной перистальтики пищевода. Пищевод, в покое, находится в сокращенном состоянии; Тем не менее, во время глотания, ингибирующие нейроны возбуждаются, чтобы подавить действие стимулирующих, что приводит пищевод к релаксации. Перистальтика является чистым результатом координированной релаксации и сжатия, опосредованным ингибирующими и стимулирующими нейронами подслизистого сплетения на протяжении пищевода. При ахалазии происходит потеря оксида азота (NO) и вазоактивного интестинального пептида, высвобождающихся из ингибирующих нейронов. Таким образом, потеря ингибирующей иннервации при ахалазии приводит нарушению релаксации нижнего сфинктра пищевода, а также потери перистальтики его на всем протяжении.
Патофизиологически потеря ингибиторной иннервации пищевода может быть обусловлена как внешними, так и внутренними причинами. Внешние причины могут включать в себя поражения центральной нервной системы (ЦНС), связанные с дорсальным двигательным ядром блуждающего нерва, в то время как внутреннее нарушение может быть связано с потерей ингибирующих ганглиозных клеток в подслизистом сплетении пищевода.
Kimura был первым, кто предположил, что поражения в ЦНС может объяснить клинические и манометрические изменения при ахалазии. В 1929 году он исследовал гистологические секции посмертных образцов трех больных ахалазией. Он обнаружил дегенерацию нервных клеток в дорсальном двигательном ядре блуждающего нерва. Про подобное наблюдение позже сообщает Cassella. Его группа провела гистологическое исследование серийных стволовых секций мозга двух больных ахалазией и одного контрольного. Они обнаружили снижение числа нейронов в дорсальном двигательном ядре блуждающего нерва на 34% до 43% на двусторонней основе у больных ахалазией по сравнению с контрольным образцом. Для проверки результатов указанных выше наблюдений, Higgs вызвал двухсторонние повреждения дорсальных двигательных ядер блуждающего нерва у 13 кошек с использованием постоянного тока. У 9 из 13 кошек с поражением дорсальных двигательных ядер (69%) развились манометрические и рентгенологические симптомы, связанные с ахалазией. Таким образом, эти исследования показывают, что повреждения, расположенные в центральной нервной системе, могут привести к манометрической симптоматике ахалазии.
Нарушения в волокнах блуждающего нерва за пределами центральной нервной системы также было связано с ахалазией. С помощью электронного микроскопа, Cassella обнаружил аномалии блуждающего нерва, подобные Валлеровой дегенерации у больных ахалазией. Кроме того, у пациента после высокой селективной ваготомии по поводу рецидива кровотечения язвы двенадцатиперстной кишки были обнаружены при манометрии изменения, подтверждающие ахалазию. Тем не менее, большинство пациентов после ваготомии не имеют симптомов ахалазии, вероятно что такое сообщение является изолированным атипическим случаем. Также возможно, что изменения в волокнах блуждающего нерва и гибель нейронов дорсальных двигательных ядер у перечисленных больных ахалазией являются вторичными явлениями, вызванными потерей контакта с конечным органом, в подслизистом сплетении пищевода. По факту, внешние нарушения иннервации являются редкой находкой у больных ахалазией и, вероятнее всего, не являются основным механизмом заболевания.
Исследования показывают, что более вероятно, нейронным нарушением при ахалазии является дисбаланс между стимулирующими и ингибирующими нейронами подслизистого сплетения. Интактность холинергических стимулирующих нейронов была показана Holloway в case-control исследовании 27 больных ахалазией и 21 здорового человека. Холинергические и антихолинергические препараты вводили в обеих группах с последующей пищеводной манометрией. Антихолинергические препараты уменьшили давление нижнего пищеводного сфинктера в обеих группах, в то время как холинергические препараты увеличили – это подтверждение того, что холинергические нейроны при ахалазии сохраняются. Это тот же самый механизм, через который ботулинический токсин уменьшает давление нижнего пищеводного сфинктера и показывает эффективность при лечении ахалазии.
Тем не менее, в отличие от интактной стимулирующей иннервации, многие физиологические исследования показывают либо отсутствие, либо нарушение ингибиторной иннервации при ахалазии. Dodds провел case-control исследование, в котором 24 пациентов с ахалазией получали болюсно дозу холецистокинина октапептида. Контрольная группа, состоящая из семи добровольцев и 32 пациентов без признаков идиопатической ахалазии, которые были направлены на пищеводную манометрию, также получали дозу холецистокинина октапептида. В контрольной группе, возбуждение обоих ингибирующих нейронов и гладких мышц нижнего пищеводного сфинктера с использованием холецистокинина октапептида приводило к чистому эффекту релаксации нижнего пищеводного сфинктера. Это происходит потому, что ингибирующие нейроны преобладают над стимуляцией гладких мышц нижнего пищеводного сфинктера. Тем не менее, у пациентов с ахалазией, введение холецистокинина октапептида вызвало парадоксальное увеличение давления нижнего пищеводного сфинктера из-за того, что отсутствие тормозных нейронов приводит к беспрепятственному прямому стимулирующему эффекту холецистокинина октапептида на гладкие мышци (рис. 2), тем самым, усиливая отсутствие ингибиторных нейронов у больных ахалазией. Следовательно, этот тест может быть клинически использован у больных с постфундопликационной дисфагией и подозрением на наличие ахалазии. Если введение холецистокинина октапептида в этой группе приводит к увеличению давление покоя нижнего пищеводного сфинктера, то вполне вероятно, что пациент страдает ахалазией.
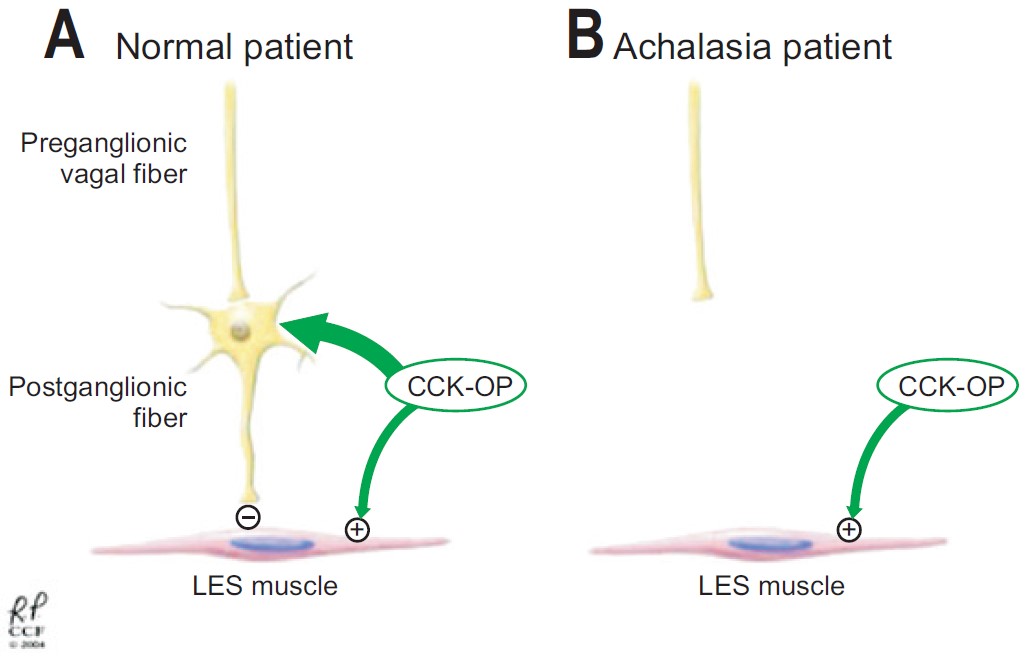
Рисунок 2.Источник: AtesF, VaeziMF. The Pathogenesis and Management of Achalasia: Current Status and Future Directions. GutandLiver. 2015;9(4):449-463. doi:10.5009/gnl14446.
Потеря тормозных нейронов в качестве первичной патологии при идиопатической ахалазии также подтверждается в исследованиях ингибирующих нейротрансмиттеров. Вазоактивный интестинальный пептид как тормозной нейромедиатор пищеводного подслизистого сплетения показал, что в состоянии вызвать расслабление гладких мышц «in vitro» и расслаблять нижний пищеводный сфинктр «in vivo». Последующие исследования показали, что волокна содержащиеся в нижнем пищеводном сфинктере, которые присутствуют в норме в пищеводном подслизистом сплетении, отсутствуют либо их количество снижено у больных с ахалазией. Более поздние исследования, однако, указывают на оксид азота (NO) в качестве основного тормозного нейромедиатора в подслизистом сплетении пищевода. Исследования на животных показывают, что NO контролирует нервно-мышечную функцию пищевода, включая расслабление нижнего сфинктера и нормальную перистальтику. Значительные потери оксида азота в нейронах были обнаружены у больных ахалазией. Также, когда оксид азота инактивировали у здоровых добровольцев путем введения рекомбинантного человеческого гемоглобина, результаты манометрического исследования пищевода были похожими на такие, которые выявлялись при ахалазии. NО-нейроны и нейроны вазоактивного интестинального пептида обычно сосуществуют в подслизистом сплетении пищевода и их потеря, возможно одновременная, клинически приводит к проявлениям, которые наблюдается у пациентов с ахалазией.
На основании существования семейных случаев заболеваемости можно предположить, что в какой-то степени ахалазия является наследственным заболеванием. Семейные случаи в основном отмечаются в педиатрической практике, между братьями и сестрами, а в ряде случаев у монозиготных близнецов. Есть также несколько сообщений о родитель-ребенок ассоциированной ахалазии. Хотя эти свидетельства показывают, аутосомно-рецессивный тип наследования этого заболевания, редкость семейного появления не подтверждают гипотезу о том, что генетическое наследование является существенным этиологическим фактором в большинстве случаев ахалазии. Вместо этого предлагается, что генетическая предрасположенность у таких лиц, вероятно, повышает их восприимчивость к приобретению ахалазии после воздействия общих факторов окружающей среды, которые могут играть определенную роль в патогенезе.
Несколько исследований предположили возможную связь между вирусными инфекциями и ахалазией. В таких исследованиях, различные вирусные антитела были измерены в сыворотке крови больных с ахалазией и нормальной контрольной группой, в группе больных ахалазией оказались выше антитела только к вирусу ветряной оспы и кори. С другой стороны, в клинических условиях не у всех пациентов с корью и ветряной оспой будет развиваться ахалазия. С помощью полимеразной цепной реакции, другие исследования не показали никаких признаков каких-либо вирусных продуктов в ткани пищевода у больных ахалазией. Кроме того, даже в тех исследованиях, в которых нашли доказательства наличия вируса, невозможно установить причинно-следственную связь. Имеющиеся данные свидетельствуют о том, что инфекция не может быть причиной для пищеводной ахалазии. Единственной сильной уликой в пользу инфекции в патогенезе ахалазии, однако, является тот факт, что болезнь Шагаса, вызванная Trypanosoma cruzi, очень схоже имитирует патофизиологию первичной ахалазии.
Увеличение распространенности циркулирующих антител к подслизистому сплетению пищевода у некоторых больных ахалазией привело к предложению роли аутоантител в патогенезе этого заболевания; Тем не менее, в исследовании Moses предположил, что циркулирующие антитела являются, скорее всего, результатом неспецифической реакции на патологические процесс, а не являются причиной заболевания. Эта идея подтверждалась обнаружением подобных антител у пациентов без ахалазии. Ультраструктурные исследования ткани пищевода у пациентов с ахалазией также обнаружили, воспалительные инфильтраты вокруг подслизистых нейронов, в то время как в контрольной группе нормальное подслизистое сплетение было без инфильтрации.
ДИАГНОСТИКА
Наиболее частыми симптомами ахалазии являются дисфагия, как для твердой пищи, так и для жидкостей, регургитация слюны и непереваренной пищи, респираторные осложнения (ночной кашель и аспирация), боль в груди, изжога, потеря веса. Изжога может имитировать гастроэзофагиально-рефлюксную болезнь (ГЭРБ). Дисфагия и регургитация, как правило, реагируют на лечение, но боль в груди гораздо труднее поддается лечению. Наиболее часто для оценки симптомов, стадии и эффективности лечения используется шкала Eckardt (таб. 1). При подсчете: количество баллов 0-1 соответствует клинической стадии 0, баллы 2-3 соответствуют стадии I, количество 4-6 соответствуют стадии II, и > 6 баллов – стадии III. Стадии 0 и I указывают на ремиссию заболевания. С другой стороны, стадии II и III показывают отсутствие эффекта от лечения.
Таблица1.Оценка двигательной функции пищевода является основной в диагностике ахалазии. Рентгенограмма пищевода с контрастированием барием и эзофагогастродуоденоскопия (ЭГДС) являются дополнительными тестами к манометрическому исследованию пищевода в диагностике и лечении ахалазии. Тем не менее, ни ЭГДС ни рентгенограмма пищевода с барием в отдельности не являются достаточно чувствительными методами исследования, чтобы установить диагноз ахалазии с уверенностью. ЭГДС может быть использована для подтверждения диагноза ахалазии лишь у одной трети пациентов, в то время как рентгенограмма пищевода у трети пациентов может не иметь вообще ни какой диагностической ценности. Таким образом, "нормальные" результаты на ЭГДС или рентгенограмме пищевода у пациентов с подозрением на наличие ахалазии должны побудить к исследованию моторики пищевода. Тем не менее, даже у пациентов с классическими эндоскопическими и/или рентгенологическими симптомами, исследование моторики пищевода будет считаться предпочтительным для подтверждения диагноза.
Манометрические симптомы отсутствия перистальтики и неполной релаксации нижнего пищеводного сфинктера без признаков механической непроходимости подтверждают диагноз ахалазии (рис.3).
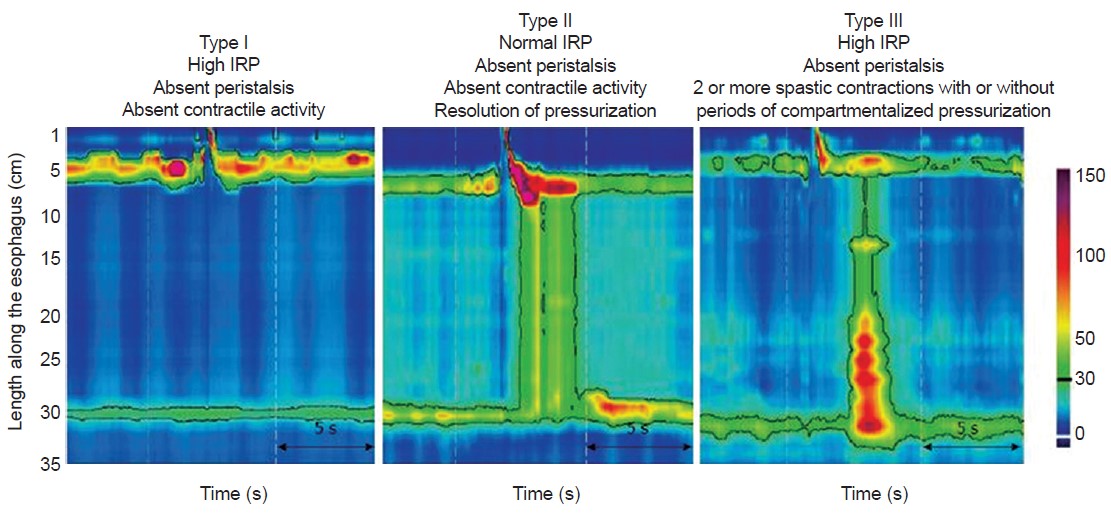
Рисунок 3.Источник: Torresan F., Ioannou A., Azzaroli F., Bazzoli F. Treatment of achalasia in the era of high-resolution manometry. Ann Gastroenterol 2015; 28 (1): 1-8
Манометрические методы и оборудование, доступные в клинической практике, от обычных катетеров с датчиками давления на расстоянии от 3 до 5 см друг от друга с использованием твердотельной технологии, или водно-перфузионные катетеры с высоким разрешением манометрии, которые включают датчики давления с интервалом в 1 см. Любая из текущих манометрических систем могут быть использованы для оценки релаксации нижнего пищеводного сфинктера.
Топография пищеводного давления на основании манометрии высокого разрешения позволила дифференцировать ахалазию на три варианта с возможностью прогнозировать их потенциальные результаты лечения (Чикагская классификация):
• II подтип – ахалазия с повышенным давлением на протяжении всего пищевода;
• III подтип – спастическая ахалазия.
На сегодняшний день три отдельных ретроспективных когортных исследования показали, что подтип II имеет лучший прогноз, в то время как подтип I несколько хуже и подтип III может быть трудно поддающимся лечению. Хотя эти подтипы могут быть определены при тщательном анализе данных обычной манометрии, все-таки легче выполняется дифференцировка по данным манометрии высокого разрешения.
Диагноз ахалазии подтверждается рентгенологическими симптомами такими, как дилатация пищевода, узкое пищеводно-желудочное соединение с "мышиным хвостом", отсутствие перистальтики, и плохая эвакуация бария. Рентгенологическое исследование также может быть полезным в тех случаях, когда пищеводная манометрия дала не однозначные результаты. В добавок к подтверждению диагноза ахалазии, рентгенологическое исследование также полезно для оценки поздних изменения пищевода при ахалазии (извитость, ангуляцию, megaesophagus), которые имеют важное значение для лечения.
Определяющей ролью рентгенологического исследования является возможность объективно оценит эвакуаторную функцию пищевода после проведенной терапии. У многих пациентов, облегчение симптомов не всегда параллельно улучшает опорожнение пищевода.
Основная роль ЭГДС в диагностике сосредоточена на исключении механических препятствий или псевдоахалазии, поскольку они могут имитировать ахалазию как клинически, так и манометрически. Клинические проявления дисфагии, в сочетании с более старшим возрастом, потерей веса и короткой продолжительностью симптомов могут наводить на мысль о раке; тем не менее, эти признаки не специфичны. Таким образом, пациентов с нарушением моторики пищевода связанной с ахалазией следует направлять на ЭГДС, чтобы исключить рак.
Эндоскопическая оценка также может быть полезна для повышения настороженности в диагностике ахалазии у больных, которым ошибочно установлен диагноз ГЭРБ. В этой группе, эндоскопические симптомы, такие как дилатация пищевода с остаточной пищей или слюной и сужение желудочно-пищеводного соединения, могут быть крайне полезны для установлении правильного диагноза. Эндоскопические находки при ахалазии могут варьировать от, казалось бы, эндоскопически нормального пищевода к извилистому дилатированому сигмовидному пищеводу с сохраненной пищей. Таким образом, эндоскопия не может быть высокочувствительным методом исследования в тех случаях, когда пищевод сохраняет нормальные размеры, поэтому исследование моторики пищевода показано всегда, если есть клиническое подозрение на ахалазию. Эндоскопические слизистая оболочка при ахалазии может быть нормальной, однако, при дилатации, не редко, имеют место воспалительные изменения или изъязвления, являющиеся вторичными и вызванные стазом, лекарственным эзофагитом, или грибковой инфекцией.
Таким образом, для диагностики ахалазии, исследование пищеводной моторики, ЭГДС и рентгенологические исследования пищевода с барием играют взаимодополняющие роли. В то время как ЭГДС важно, для исключения псевдоахалазии, исследование пищеводной моторики и рентгенологические исследования с барием могут играть роль подтверждающих диагноз.
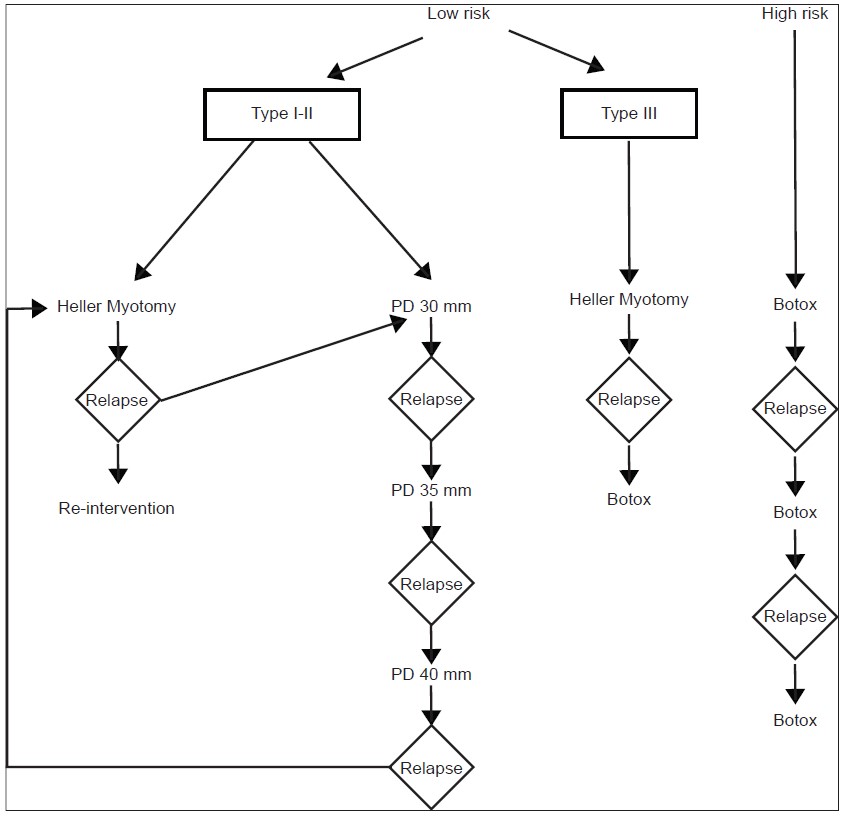
Рисунок4.Источник: Torresan F., Ioannou A., Azzaroli F., Bazzoli F. Treatment of achalasia in the era of high-resolution manometry. Ann Gastroenterol 2015; 28 (1): 1-8
ЛЕЧЕНИЕ
Ахалазия является хроническим неизлечимым заболеванием. Современные методы лечения ахалазии направлены на снижение гипертонуса нижнего пищеводного сфинктера фармакологическим, эндоскопическим или хирургическим путем. Ни одно из вмешательств существенно не влияет на перистальтику пищевода и, несмотря на лечение, гипертонус нижнего пищеводного сфинктера с течением времени возвращается, что требует повторных вмешательств. Целью лечения ахалазии является, облегчение симптомов, улучшение опорожнения пищевода, и предотвращение дальнейшего расширения пищевода. Для достижения этих целей, доступный спектр лечебных методов должен быть адаптирован к пациентам с ахалазией, адекватно по необходимости и показаниям, согласно алгоритмам (рис. 4).
• Фармакологические методы лечения
Оральные фармакологические методы лечения являются наименее эффективными вариантами лечения ахалазии. Блокаторы кальциевых каналов и нитраты длительного действия две наиболее распространенных группы препаратов, используемых для лечения ахалазии. Они временно снижают давление нижнего пищеводного сфинктера расслаблением гладкой мускулатуры, что облегчает опорожнение пищевода. Ингибиторы фосфодиэстеразы 5 типа, Силденафил, также показывают снижение тонуса нижнего пищеводного сфинктера у пациентов с ахалазией. Другие менее часто используемые лекарства включают антихолинергические препараты, бета-адренергические агонисты (тербуталин) и теофиллин. В целом, блокаторы кальциевых каналов уменьшают давление нижнего пищеводного сфинктера на 13-49% и улучшение симптомов отмечается у пациентов в 0-75% случаев. Наиболее часто применяется блокатор кальциевых каналов нифедипин, показывающий время достижения максимального эффекта после приема через 20-45 мин и продолжительность эффекта от 30 до 120 мин. Таким образом, он должен быть использован (10-30 мг) сублингвально за 30- 45 минут до еды для достижения наилучшего эффекта. Сублингвально изосорбида динитрат также эффективен при уменьшении давления нижнего пищеводного сфинктера на 30-65%, что приводит к улучшению симптоматикиу 53-87%. Он имеет более короткое время для максимального снижения давления (3-27 мин), чем нифедипин, но и имеет более короткую продолжительность действия (30-90 мин). Следовательно, сублингвально изосорбида динитрат (5 мг) обычно принимают только за 10-15 мин до еды. Единственное сравнительное исследование сублингвального нифедипина и сублингвально изосорбида динитрата показало недостоверное преимущество в снижении давления нижнего пищеводного сфинктера последнего (65%), чем первого (49%). Кратковременный клинический ответ на фармакологические агенты и побочные эффекты, такие как головная боль, гипотония и отеки ног, являются общими сдерживающими факторами в их использовании. Кроме того, они не обеспечивают полное облегчение симптомов. Таким образом, данные препараты обычно «берегуться» для пациентов с ахалазией, которые не могут или отказываются пройти более действенные методы лечения (балонная дилатация или хирургическая миотомия), а также для тех, у кого инъекции ботулотоксина не оказали эффекта.
• Эндоскопическая фармакологическая терапия
Ботулинический токсин (Botox) является мощным ингибитором пресинаптического высвобождения ацетилхолина из нервных окончаний, который доказано, является успешным в лечении ахалазии. Токсин расщепляет белок (SNAP-25), что, в свою очередь, ингибирует экзоцитоз ацетилхолина в синаптическое пространство и вызывает кратковременный паралич мышц, блокируя холинергическую стимуляции пищеводного сфинктера, которая лишена ингибирующего влияния при ахалазии. Тем не менее, это не оказывает никакого влияния на миогенное поддержание базального тонуса нижнего пищеводного сфинктера. Таким образом, лечение ограничено, и эффективность лечения связаны с уменьшением базального давлении сфинктера ~ 50%. Этого снижения может быть достаточно, чтобы позволить пищеводу опорожняться, когда давление пищевода поднимется до уровня, превышающего давление частично парализованного нижнего пищеводного сфинктера.
Основная привлекательность лечения с использованием ботулинического токсина является удобный подход, который не намного сложнее, чем выполнение плановой эндоскопии, а также низкий процент серьезных осложнений. 12-месячный уровеньэффективности отмечается от 35 до 41%. Несмотря на это, начальный уровень ответа (один месяц) высокий (> 75%), терапевтический эффект в конечном счете снижается и необходимость повторить инъекции требуется у значительной части пациентов. Приблизительно у 50% пациентов, рецидивы требуют повторения процедуры с 6-24-месячными интервалами. Длительная реакция чаще наблюдается у пациентов пожилого возраста. Тем не менее, также длительный эффект может быть связан с ахалазией подтипа II, при которой повышенное давление отмечается на протяжении всего пищевода. Серьезные побочные эффекты встречаются редко и основные проблемы в 16-25% это развития боли в грудной клетке и редкие осложнения, такие как медиастинит и аллергические реакции, связанные с яичным белком. Кроме того, множественные процедуры могут вызывать воспалительные реакции, которые могут затрагивать через слизистую оболочку мышечный слой, что связывается в дальнейшем с более высокой частотой послеоперационных осложнений. Кроме того, существуют свидетельства того, что инъекции ботулинического токсина в нижний пищеводный сфинктер могут увеличить техническую сложность последующей хирургической миотомии. Учитывая эти особенности, использование ботулинического токсина ограничено определенными специфическими обстоятельствами, при которых балонная дилатация и хирургическая миотомия не считается целесообразным из-за рисков, связанных со здоровьем пациента. В качестве альтернативы, ботулинический токсин может рассматриваться как дополнительная терапия у больных с остаточными спастическими сокращениями выше уровня миотомии или нижнего пищеводного сфинктера.
• Баллонная дилатация
Баллонная дилатация (БД) является наиболее эффективным нехирургическим вариантом лечения пациентов с ахалазией. Все пациенты, рассматриваемые для БД также должны быть кандидатами на хирургическое вмешательство в случае перфорации пищевода. БД использует давление воздуха для внутрипищеводного расширения круговых мышечных волокон нижнего пищеводного сфинктера. Процедура всегда выполняется под наркозом и традиционно под контролем рентгеноскопии, хотя существуют данные свидетельствующие, что прямой эндоскопический контроль для позиционирования баллона может быть также использован. Наиболее важными нюансами при выполнении БД являются компетентность оператора и наличие подготовленного обеспечения для выполнения оперативного вмешательства в случае перфорации пищевода. После дилатации, все пациенты должны пройти рентгенологический контроль с гастрографином с последующей рентгенограммой пищевода с барием, чтобы исключить перфорацию пищевода. БД может выполняется также в амбулаторных условиях, и пациенты могут быть выписаны после дилатации. Пациентам следует указать на необходимость немедленно обратиться за помощью, если они почувствуют сильную боль в груди с лихорадкой или без после выписки.
• Хирургическая миотомия
Оригинальный метод хирургической миотомии подразумевал разделение мышечных волокон нижнего пищеводного сфинктера (круговго слоя без разрушения слизистой оболочки) из торакотомического доступа. Результаты от «хорошего» до «великолепного» достигались в 60-94% случаев, и продолжали сохраняться 1-36 лет, данная методика по-прежнему уже в течение многих лет остается операцией выбора. Изначально метод развивался из лапаротомического доступа, который впоследствии был вытеснен малоинвазивными методами. Был разработан также торакоскопический подход и с успехом применялся, но лапароскопическая миотомия стала более предпочтительным способом из-за меньшей травматичности и более быстрого восстановления.
Исследования, сравнивающие эффективность хирургических методов не являются однородными по продолжительности и определению успешности лечения. Кроме того, имеющаяся литература основана на перспективных или ретроспективных case-control исследованиях, так как нет никаких рандомизированных контролируемых исследований, сравнивающих различные подходы к миотомии. В 13 исследованиях открытой трансторакальной миотомии, которые включали в общей сложности 842 пациентов, улучшение симптомов было достигнуто в среднем у 83% пациентов (диапазон 64-97%). В 10 исследованиях (732 пациентов) при открытой абдоминальной миотомии, улучшение симптомов было достигнуто у 85% (в диапазоне от 48-100%) пациентов. Данные по торакоскопической миотомии (211 пациентов) из 8 исследований, демонстрируют улучшение симптомов в среднем у 78% (в диапазоне 31-94%) пациентов. И, наконец, в 39 исследованиях лапароскопической миотомии, которые включали в общей сложности 3086 пациентов, улучшение симптомов было достигнуто в среднем у 89% пациентов (диапазон 77-100%). Как и в случае БД, эффективность миотомии по Heller уменьшается с увеличением периода после операции. В исследовании из 73 пациентов, которым была выполнена миотомия по Heller, отличные/хорошие результаты были отмечены у 89% пациентов в течение 6 месяцев и у 57% пациентов через 6 лет наблюдения.
Развитие ГЭРБ после миотомии является частой проблемой, и вопрос о целесообразности выполнения профилактических процедур для предотвращения рефлюкса был предметом широких дискуссий, особенно с учетом увеличения числа случаев послеоперационных дисфагий у пациентов перенесших фундопликацию. Средняя частота ГЭРБ после хирургической миотомии без фундопликации для торакотомии, лапаротомии, торакоскопии и лапароскопии составляет: 29%, 28%, 28% и 31% соответственно. Добавление фундопликации после миотомии снижает риск развития ГЭРБ для торакотомии, лапаротомии и лапароскопии до 14%, 8% и 9%, соответственно. Ни одно исследование не включало фундопликацию после торакоскопической миотомии. Преимущество добавления фундопликации было продемонстрировано в двойном слепом рандомизированном исследовании миотомии с фундопликацией по сравнению с миотомией без фундопликации. В данном исследовании при выполнении рН мониторинга нарушение был обнаружен у 47% пациентов без противорефлюксных процедур и у 9% больных, которым була выполнена также задняя фундопликация по Dor. Кроме того, последующий анализ стоимости-полезности на основании результатов этого рандомизированного двойного слепого исследования обнаружил, что миотомия плюс фундопликация по Dor была более экономически эффективной чем миотомия в одиночку из-за последующих расходов на лечение ГЭРБ. Самые последние рекомендации по лечению ахалазии Общества американских желудочно-кишечных и эндоскопических хирургов настаивают, чтобы пациентам, которые подвергаются миотомии необходимо также выполнять фундопликацию для предотвращения рефлюкса. И хоть было достаточно хорошо установлено, что добавление фундопликации является полезным для снижения рисков развития ГЭРБ после миотомии, не хватает уверенности в выборе лучшего метода (передняя Dor или задней Toupet). Учитывая вероятность симптомов рефлюкса и/или нарушения рН после миотомии несмотря на добавленную фундопликацию, терапия ингибиторами протонной помпы может быть назначена тем пациентам, кто жалуется на изжогу.
• Пероральная пищеводная эндоскопическая миотомия «POEM»
Несмотря на то, что современные методы лечения ахалазии являются достаточно эффективными, наблюдается интерес к разработке новой методики, которая включает эндоскопический подход по принципу транслюминальной эндоскопической хирургии через естественные отверстия для выполнения миотомии. Этот метод называют «POEM» (peroral endoscopic esophageal myotomy). Продольный разрез около 2 см выполняют на поверхности слизистой оболочки пищевода, чтобы создать вход в подслизистое пространство. Затем через подслизистый тоннель достигают нижний пищеводный сфинктер и рассекать круговые мышечные волокна более 7 см протяженности пищевода и 2 см желудка. Inoue изучил 17 пациентов и сообщили о показателе успеха 100% и значительном снижении давления нижнего сфинктера пищевода. Ряд других исследований подтвердил высокий уровень успеха (85-100%), даже после нескольких предыдущих БД, но несмотря на это дальнейшее наблюдения составляет всего 6 месяцев. Кроме того, поскольку антирефлюксные процедуры не выполняются при этой технике, риск развития ГЭРБ составляет до 46%.
• Эзофагэктомия
У некоторых пациентов может развиться "конечная стадия" ахалазии, которая характеризуется megaesophagus или сигмовидным пищеводом, значительной дилатацией и извитостью пищевода. В этой группе пациентов, БД могут быть менее эффективными, но хирургическая миотомия может быть разумной первоначальной попыткой перед постановкой вопроса о выполнении эзофагэктомии. В двух недавних исследованиях задокументировано симптоматическое улучшение после миотомии у 92% и 72% пациентов с megaesophagus. Тем не менее, в случае, отсутствия эффекта лечение, резекция пищевода часто требуется. Эзофагэктомия связано с большей заболеваемостью/смертностью, чем лапароскопическая миотомия по Heller, и должна быть запасной для пациентов, у которых БД и/или миотомия были неэффективны и которые являются хорошими кандидатами для операции. Данные из неконтролируемых исследований показывают, как правило, хороший ответ на эзофагэктомии с улучшением симптомов более чем у 80% пациентов с терминальной стадией ахалазии; смертность колеблется в пределах от 0 до 5,4%. Существует нехватка исследований, сравнивающих два основных подхода к эзофагэктомии, то есть, дальнейшей интерпозиции желудка или толстой кишки. Тем не менее, в последнее время обширный обзор по этой теме показал, что желудочная интерпозиция является первым выбором терапии у большинства пациентов, подвергающихся эзофагэктомии.

